PRÓLOGO
Logo BioReAcToR |
En continuación de Principios básicos del diseño de biorreactores. Parte 1- Cultivos y Biorreactores: El Propósito de Utilización. La Parte 2B- trata específicamente de Balances Generales Por Modo de Operación. Tema tratado en DISEÑO DE BIOREACTORES, Parte 3 y MODELIZACIÓN DE BIOPROCESOS INDUSTRIALES de mi Blog Biotecnología Práctica. Pero renovado y actualizado con el objetivo de renovar algunos conceptos, aclarar otros e introducir nuevos.
BALANCE GENERAL POR MODO DE OPERACIÓN DE UN BIORREACTOR

El modo de operación de un sistema de cultivo, es sinónimo del modo de operación de un biorreactor. Eso influye y afecta directamente el diseño de un biorreactor. Así como, el modelo cinético de crecimiento, el tiempo de cultivo en biorreactor y el proceso de producción en biorreactor.
Existen tres modos de cultivo asociados a tres modos básicos de operación:
Operación Discontinua en Biorreactores: Operación por Lotes en Biorreactores
“Se caracteriza por la inoculación de un medio de cultivo estéril con microorganismos, por un período específico de reacción. Durante este tiempo, se alteran las concentraciones de células, sustrato (fuente de carbono, sales, nutrimentos, vitaminas, etc.) y producto. Una buena mezcla asegura que no existan diferencias locales significativas en la composición y en la temperatura de la mezcla de reacción. Por otra parte, la reacción no es estacionaria.”. Fuente: “Operación por lotes”.

En un sistema de operación discontinua la condición fundamental de flujo es: E = 0 = S. “El flujo de entrada y el flujo de salida son cero: F1 = 0 = F2”.
La curva de producción X(t) de un sistema que opera en discontinuo (por tandas o lotes) se caracteriza porque tiene un inicio con crecimiento cero (recta negra); tiene un crecimiento exponencial rápido; seguido por un estancamiento de la producción curvo y corto; con un decaimiento (muerte del cultivo) que inicia apenas se agota el substrato limitante de la velocidad de crecimiento.

Operación Semicontinua en Biorreactores: Operación Por Lotes Alimentados en Biorreactores
En un sistema de operación semicontinua la condición fundamental de flujo es: S = 0 → E = F. “El flujo de salida es cero: F1 = F; F2 = 0”.

“Puede considerarse como una combinación de las dos operaciones anteriormente descritas (por lotes y continua). Se practican muchas variaciones de este tipo de proceso. La más popular involucra iniciar el reactor como si se tratara de un proceso por lotes y cuando el sustrato que limita el crecimiento (por lo general la fuente de carbono) se consuma, se alimenta al reactor de una manera específica (proceso por lotes con alimentación), o la concentración del sustrato se mantiene constante por medio de cultivos extendidos. Además, se practica frecuentemente la adición programada de sustrato para la producción de metabolitos secundarios, en la cual, el crecimiento celular y la formación de producto ocurren por lo general en fases separadas.”. Fuente: “Operación semicontinua”.

La curva de producción X(t) de un sistema que opera en semicontinuo (operación alimentada) no tiene un inicio con crecimiento cero; tiene una curva de crecimiento acelerada; tiene un crecimiento estacionario largo y prolongado que se da después de haber alcanzado el máximo de crecimiento; seguido por el decaimiento y muerte del cultivo.
Operación Continua en Biorreactores: Operación de un Quimiostato
En un sistema de operación continuo la condición fundamental de flujo es: E= S. “El flujo de entrada (F1) es igual al flujo de salida (F2): F1 = F2 = F”.

“Caracterizada por el hecho que el medio de cultivo se alimenta continua y homogéneamente al biorreactor y debe ser constante, si se opera en estado estacionario; el medio añadido puede ser estéril o contener los microorganismos que se van a utilizar. La mezcla reaccionante se extrae del reactor también de forma continua. Todas las variables de reacción y los parámetros de control permanecen constantes a través del tiempo; como resultado de lo anterior, se establece un estado estacionario en el reactor seguido por una productividad y una salida constantes.”. Fuente: “Operación continua”.

La curva de producción X(t) de un sistema que opera en continuo (quimiostato) no tiene un inicio con crecimiento cero; es creciente y exponencial, hasta lograr su crecimiento máximo, en el estado estacionario (E.E); que se sostiene y mantiene constante el tiempo durante todo el estado estacionario; y no tiene decaimiento o muerte del cultivo.
ECUACIÓN DE BALANCE GENERAL POR SISTEMA DE FLUJO EN BIORREACTOR
El Balance General para cualquier tipo de operación de flujo se establece para un componente cualquiera del cultivo (incluida la biomasa) como lo plantea la Ecuación (1).

La variación del volumen del cultivo en función del tiempo está dada por la Ecuación (2).

Nota: en términos de flujo la Ec. 2 se denomina flujo volumétrico (Q) y tiene unidades de m3/s.
Cuando el modo de cultivo es continuo, ambos caudales son iguales (F1 = F2) y el volumen (V) es constante, por lo que, la Ec. (2) se reduce a cero (0) y la Ec. (1) se transforma en la Ecuación (3).

Nota: la Ec.3 que se conoce como ecuación de balance para una operación continua en estado estacionario. De no existir el estado estacionario (EE) se producirían dentro del biorreactor dos condiciones de flujo indeseables:
1. Si F1 > F2 se produce el rebalse o desborde del biorreactor, condición que se da cuando el flujo de entrada sobrepasa la capacidad del biorreactor.
2. Si F2 > F1 se produce el lavado o drenado de producto o biomasa, condición que se da cuando el flujo de salida sobrepasa la capacidad del biorreactor.
En una operación de flujo en modo semicontinuo, se anula el término F2Ci del balance general de materia Ec. (1). Resultando esta en la Ecuación (4).

Nota: Cuando el modo de operación es semicontinuo el caudal de salida F2 es nulo (F2 = 0) por lo que, el volumen V aumentará con el tiempo en función del caudal de entrada F. 
Cuando el modo de operación es discontinuo ambos caudales son nulos (F1 = F2 = 0) por lo que, el volumen V es constante y se anulan los términos F1Cio y F2Ci en la Ec. (1); transformándola en la Ecuación (5).

Nota: La duración de un cultivo discontinuo es también, limitada en el tiempo, pero se diferencia de la del cultivo semicontinuo en que, depende únicamente de las condiciones iniciales del cultivo; esto por cuanto, no existe alimentación (F1).
Balances y Ecuaciones de Biorreactores en el Estado Continuo
Los balances de materia para la biomasa (X), el sustrato (S) y el producto (P) para un biorreactor que opera en el Estado Continuo (E.E) son:
Balance de Biomasa en el Estado Continuo
VdX/dt = -FX + Vrx = -F/X + VµX = 0; rx = mx; E.E » dX/dt = 0
Por definición: D = velocidad de dilución = F/V » µ = D
Balance de Sustrato en el Estado Continuo
VdS/dt = F (So – S) – Vrs; rs = µX/Yx/s; E.E » dS/dt = 0
Por definición: SEE = KsD/µm – D » XEE = Yx/s (S0 – S)
Donde: D = velocidad de dilución; SEE = concentración del sustrato limitante de la velocidad en estado estacionario; XEE = concentración de biomasa en estado estacionario.
Balance de Producto en el Estado Continuo
VdP/dt = -FP + Vrp = PEE = qpX /D; rp = qpX; E.E » dP/dt = 0
Por definición: PEE = YP/X (µ+mp)
Donde: PEE = concentración del producto en el estado estacionario.
Nota: cuando el sustrato limitante de la velocidad de crecimiento (S) es también la fuente de carbono.
X = DY´X/S (So – SEE) / (D + ms Y´X/S)
Balances y Ecuaciones de Biorreactores en Estado Semicontinuo
Los balances de materia para la biomasa (X), el sustrato (S) y el producto (P) para un biorreactor que opera en el Estado Semicontinuo (Alimentado) son:
Balance de Biomasa en el Estado Semicontinuo
d(VX)/dt = Vrx = VµX
Balance de Sustrato en el Estado Semicontinuo
d(VS)/dt = FSo – Vrs
Balance de Producto en el Estado Semicontinuo
d(VP)/dt = Vrp
Nota: en una operación en el Estado Semicontinuo el volumen V permanece dentro del operador diferencial; ya que, varía con el tiempo.
Balances y Ecuaciones de Biorreactores en el Estado Discontinuo
Dado que F1 = F2 = 0, las ecuaciones de balance de materia para la biomasa (X), el sustrato (S) y el producto (P) para un biorreactor que opera en el Estado Discontinuo son:
Balance de Biomasa en el Estado Discontinuo
d(X)/dt = rx = µX
Balance de Sustrato en el Estado Discontinuo
d(S)/dt = rs = µX/Yx/s
Balance de Producto en el Estado Discontinuo
d(P)/dt = rp
ECUACIÓN DE BALANCE INDIVIDUAL POR COMPONENTE EN BIORREACTOR
La Figura 2 muestra el Balance de Masa Individual para un Componente (y) en una operación continua con transferencia de masa (Fi, Fo) a través del volumen de control (V) del biorreactor, a una velocidad molar (Ny) conocida como velocidad de transformación.

| Figura 2. Balance de Materia para un Componente (y) |
Los balances individuales; ya sea que, se trate de un balance de masa o un balance molar. Se establecen por componente individual (y) del bioproceso. No obstante, también es usual establecer balances particulares tales como: el balance de biomasa (X), el balance de substrato limitante de la velocidad de crecimiento (S), y el balance producto (P). Incluso se establecen balances específicos para elementos como: oxígeno (balance de O2) y carbono (balance de C) en biorreactores con funciones especiales como el levantamiento por aire; en donde, el oxígeno disuelto en el medio líquido cumple una función nutritiva; además de la de agitación. O el de un fermentador de levadura, en donde, el azúcar cumple la función análoga de fuente de carbono.
Ecuación de Balance General de Materia para un Componente Individual ‘y’
d(Vy)/dt = (Fiyi + Vrgy + VNiy) – (Foyo + Vrcy + VNoy)
Donde: V = Volumen del biorreactor (L); Vy = volumen del componente ‘y’ dentro del biorreactor (L); Fi = Velocidad de flujo de entrada ‘i’ al biorreactor (L/hr); Fo= Velocidad de flujo de salida ‘o’ del biorreactor (L/hr); yi = Concentración del componente ‘y’ dentro del biorreactor al inicio ‘i’ del bioproceso (g/L); yo = Concentración del componente ‘y’ dentro del biorreactor al final ‘o’ del bioproceso (g/L); rgy = Velocidad de generación, formación o producción del componente ‘y’ (g/L.hr); rcy: Velocidad de consumo o utilización del componente ‘y’ (g/L.hr); Niy = Velocidad de transferencia inicial ‘i’ del componente ‘y’ del gas al líquido (g/L.hr); Noy = Velocidad de transferencia final ‘o’ del componente ‘y’ del líquido al gas ( g/L.hr); t = tiempo (hr).
Nota: las unidades comúnmente usadas para la velocidad molar (N) son g/h, kg/h, mmol/h, mol/h. Si el volumen (V) es constante, es posible simplificar la ecuación dividiendo por V ambos términos. Con lo que, la Ecuación de Balance General de Materia para un Componente Individual ‘y’ se transforma en: dV/dt = Fi – Fo y el balance se expresa en base volumétrica. Ejemplos: g/L.hr, mol/L.hr.
Ecuación de Balance de Biomasa (X)
d(VX)/dt = FiXi + VrgX – FoXo – VrcX. rgX = µX = Velocidad de crecimiento de la biomasa (g/L.hr).
Donde: rcX = kdX = Velocidad de muerte celular (g/L.hr).
Cuando el volumen (V) es constante, es posible simplificar la ecuación dividiendo por V ambos términos  Integrando
Integrando  Resolviendo la integral:
Resolviendo la integral: 

Ecuación de Balance de Sustrato (S)
d(VS)/dt = FiSi – FoSo – VrcS
 ;
;  Donde: rcS = qsX/YX/S = µx/YG + mx + qpX/Yp; c = coeficiente estequiométrico; MW = Peso Molecular.
Donde: rcS = qsX/YX/S = µx/YG + mx + qpX/Yp; c = coeficiente estequiométrico; MW = Peso Molecular.
Ecuación de Balance de Producto (P)
d(VP)/dt = FiPi – FoPo – VrgP.
 ;
;  Donde: rgP = qpX; f = coeficiente de formación; MW = Peso Molecular.
Donde: rgP = qpX; f = coeficiente de formación; MW = Peso Molecular.
Ecuación de Balance de Oxígeno Disuelto (O2)
d(VCO2)/dt = FiCO2i – FoCO2o – VrcO2 + VNO2i.

Donde: NO2 = Demanda Oxígeno (O2) = Cantidad de oxígeno requerida por unidad de tiempo y por unidad de volumen de cultivo; YO2/x = Coeficiente de rendimiento de oxígeno (O2) basado en células (x); µ = Velocidad específica de crecimiento celular.

Donde: NA = Velocidad de transferencia de oxígeno; kL = Coeficiente volumétrico de transferencia de O2 a la fase líquida (cm/hr); a = Área interfacial específica (cm2/m3); C* = Concentración (Hipotética) de O2 en el equilibrio (mM/L); C = Concentración de O2 disuelto en el seno de la fase líquida; P* = Presión (Hipotética) de O2 en el equilibrio; P = Presión de O2 en el seno de la fase gas; H = Constante de Henry.
Ecuación de Balance de Anhídrido Carbónico Disuelto (CO2)
d(VCCO2)/dt = FiCCO2i – FoCCO2o + VrgCO2 – VNCO2o.
Nomenclatura:
• V = Volumen del líquido en el biorreactor, L
• t = Tiempo, hr
• y = Concentración del componente y en el líquido dentro del biorreactor, g/L
• X = Concentración de biomasa en el líquido dentro del biorreactor, g/L
• S = Concentración de sustrato en el líquido dentro del biorreactor, g/L
• P = Concentración de producto en el líquido dentro del biorreactor, g/L
• CO2 = Concentración de oxígeno en el líquido dentro del biorreactor, g/L
• CO2* = Concentración de oxígeno en el líquido en equilibrio con el gas, g/L
• CCO2 = Concentración de CO2 en el líquido dentro del biorreactor, g/L
• F = Velocidad de flujo de líquido, L/hr
• Ni = Velocidad de transferencia de un componente delgas al líquido, g/L.hr
• No = Velocidad de transferencia de un componente del líquido al gas, g/L.hr
• rg = Velocidad de generación, formación o producción, g/L.hr
• rc = Velocidad de consumo o utilización, g/L.hr
• µ = Velocidad específica de crecimiento celular, hr-1
• qS = Velocidad específica de consumo de sustrato, g/g.hr
• qP = Velocidad específica de formación de producto, g/g.hr
• m = Velocidad específica de consumo de sustrato para mantenimiento celular, g/g.hr
• Kd = Velocidad específica de muerte o declinación celular, hr-1
• YP = Coeficiente (estequiométrico) de rendimiento de producto basado en el consumo de sustrato consumido para formación de producto, g/g
• YP/S = Coeficiente de rendimiento de producto basado en el consumo total de sustrato, g/g
• YG = Coeficiente de rendimiento de biomasa basado en el consumo de sustrato para crecimiento, g/g
• YX/S = Coeficiente de rendimiento de biomasa basado en el consumo total de sustrato, g/g
• kLa = Coeficiente volumétrico de transferencia de oxígeno, hr-1.
Subíndices:
• i = Ingreso • o = Salida • S = Sustrato • P = Producto • O2 = Oxígeno CO2 = Anhídrido carbónico.
ECUACIÓN DE DISEÑO DE UN BIORREACTOR
La Ecuación de Diseño de un Biorreactor se llama así porque se diseña a partir de la Ecuación de Balance General por Sistema de Flujo en Biorreactor para determinar el tiempo de cultivo dentro de un biorreactor según sea la operación de flujo en biorreactor.
Ecuación de Diseño de un Biorreactor Continuo
Para poder utilizar la Ecuación de Diseño de un Biorreactor primero hay que modificar la definición de componente de biomasa X y sustituirlo por conversión X del componente i (Xi).
Por definición: Xi = (Fio-Fi)/Fio.
Donde: F = flujo molar del componente i. Despejando: Fi = Fio(1-Xi) » dFi/dt = -(Fio)dXi/dt = riV. Con lo que, la ecuación de balance de biomasa para el estado estacionario se transforma en: -FXi + riV = VdXi/dt = 0.
Reordenado: V/F = ∆Xi/-ri = τ = ecuación de diseño de un reactor de mezcla perfecta. Donde: τ = tiempo de retención del cultivo dentro del biorreactor. ∆Xi = Xi2 – Xi1 = dXi.
“Otro término comúnmente utilizado en el diseño de reactores es el tiempo espacial (t) el cual define el tiempo necesario para procesar o fermentar en el biorreactor, un volumen de alimentación, medido en condiciones de entrada (presión y temperatura), igual al volumen de operación del biorreactor (el que define el estado estacionario). El tiempo espacial se obtiene dividiendo el volumen de reactor (V) entre el caudal volumétrico de entrada al biorreactor (Q). t = V/Q. Observe que al igual que t las unidades de τ son s-1.”.
Por este motivo, el tiempo de cultivo dentro de un biorreactor en un modo de operación continuo se conoce como tiempo de retención (τ) de un biorreactor.


La figura muestra las Curvas de Concentración para la Densidad Celular (X) y el Sustrato Limitante de la Velocidad de Crecimiento (S) en función del Tiempo de una Operación de Flujo en Modo Continuo.
Ecuación de Diseño de un Biorreactor Semicontinuo
Un sistema de cultivo semicontinuo es un sistema de flujo transitorio; donde hay un flujo temporal que alimenta al biorreactor; por lo que, balance general de masa que se aplica a un volumen de control (diferencial de volumen) para un componente i.
Por definición: Fi – (Fi + dFi) – (-rxi)dV = 0. Operando se obtiene: -dFi/dV = –rxi = Ecuación de Balance para un Componente i de un Biorreactor en Flujo Semicontinuo.
También, por definición la conversión del componente i en biorreactores en flujo semicontinuo es: Xi = (Fio – Fi)/Fio. Dado que no hay flujo de salida, la ecuación de balance se convierte en: FiodXi = –rxidV. Integrando la expresión obtenemos: ∫dV/Fio = ∫dXi/-rxi. Donde los límites de integración son: (0, V) para el volumen V y (Xio, Xif) para la conversión X.
Resolviendo la integral obtenemos: V/Fio = ∫dXi/-rxi = t la Ecuación de Diseño para un Biorreactor en flujo Semicontinuo.
También es posible expresar la ecuación de diseño en función de la concentración; para eso, debemos utilizar la siguiente ecuación: Fio = CioQi. Donde Cio es la concentración del componente i en la condición inicial de entrada y Qi es el caudal volumétrico del componente i.
Sustituyendo expresiones obtenemos: V/Fio = V/QiCio = τ/Cio. Donde τ es el tiempo espacial del biorreactor. En forma integral: τ = Cio∫dXi/-rxi = Tiempo Espacial para un Biorreactor en Flujo Discontinuo.
Nota: para sistemas donde la densidad (ρ) es constante: τ = – ∫dCi/-rxi.
Por este motivo, el tiempo de cultivo dentro de un biorreactor en un modo de operación semicontinuo se conoce como tiempo de residencia (tr) de un biorreactor.


La figura muestra las Curvas de Concentración para la Densidad Celular (X) y el Sustrato Limitante de la Velocidad de Crecimiento (S) en función del Tiempo de una Operación de Flujo en Modo Semicontinuo.
Ecuación de Diseño de un Biorreactor Discontinuo
Un sistema de cultivo discontinuo es un sistema discreto; en donde no hay flujo de entrada (alimentación) o de salida (lavado) de biomasa (X); por lo que, la conversión del componente i (Xi), se basa en los moles (Ni) del componente metabólico; no en la célula.
La ecuación de balance del componente i es: d(Xi)/dt = rxi = µXi. Utilizando la definición de conversión y diferenciando Ni respecto al tiempo: dNi/dt = -NiodXi/dt. Sustituyendo la ecuación de balance se transforma en: -NiodXi/dt = rxiV. Separando en variables e integrando: ∫(Nio/-rxiV) dXi = ∫dt. Donde los límites de integración para la conversión (X) son: Xio (conversión de entrada) y Xf (conversión final). Y to = 0 = tiempo inicial; tf = tiempo total de reacción = tiempo final; para el tiempo de reacción.
Integrando obtenemos: t = Nio∫dXi/-rxiV la ecuación general de diseño para un biorreactor discontinuo.
Por este motivo, el tiempo de cultivo dentro de un biorreactor en un modo de operación discontinuo se conoce como tiempo de cultivo (tc) de un biorreactor.


La figura muestra las Curvas de Concentración para la Densidad Celular (X) y el Sustrato Limitante de la Velocidad de Crecimiento (S) en función del Tiempo de una Operación de Flujo en Modo Discontinuo.
OPERACIÓN CON SISTEMA DE FLUJO EN BIORREACTOR
Existen tres operaciones adicionales, asociadas a sistemas de flujo. Estas modifican el comportamiento y la cinética del sistema. Dichas operaciones son: recirculación, derivación y purga.
Operación con Recirculación de Flujo: la recirculación en bioprocesos industriales se realiza con cuatro (4) objetivos fundamentales:
1. Recuperación de metabolitos
2. Dilución del flujo interno del bioproceso
3. Control de la variable biomasa del bioproceso
4. Circulación activa del fluido de trabajo o cultivo

Mediante ecuaciones, podemos plantear balances de materia para componentes individuales en los cuatro subsistemas distintos que se indican con líneas interrumpidas:
1. Respecto a todo el proceso, incluyendo el flujo de reciclaje. Los balances que puedan describir las ecuaciones para este sistema, no contendrán información acerca del flujo de reciclaje.
2. Respecto al punto de unión en el que la alimentación nueva se combina con el flujo de reciclaje. Las ecuaciones de balance de este sistema contienen información acerca del flujo de reciclaje.
3. Único respecto al proceso. Estos balances no contienen información acerca del flujo de reciclaje.
4. Respecto del punto de unión en el que el producto bruto se divide en reciclaje y producto neto. Contiene información acerca del flujo de reciclaje y el producto.
Además, sin violar la homogeneidad, podemos realizar balances de materia, utilizando combinaciones de subsistemas. La consecuencia de utilizar estos balances es que las ecuaciones derivadas de ellos serán dependientes. Sólo tres de los cuatro balances son independientes, si se hacen para un mismo componente.
Operación con Derivación de Flujo: una derivación es un flujo que pasa por alto una o más etapas del proceso y llega directamente a una etapa posterior. Se suele utilizar un flujo de derivación para controlar la composición de un flujo de salida final, de una unidad de proceso, al mezclar el flujo de derivación con el flujo de salida de la unidad, en las proporciones adecuadas para obtener la composición final deseada.

Operación con Flujo de Purga: una purga es un flujo que se utiliza para eliminar una acumulación de sustancias inertes o indeseables que de otra manera se acumularían en el flujo de reciclaje.

OPERACIÓN EN MODO DE CULTIVO DISCONTINUO (BATCH)
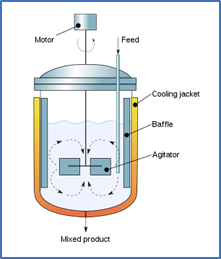
“Un reactor por lotes de mezcla completa es espacialmente homogéneo como resultado de una agitación intensa; la temperatura y el pH también pueden mantenerse uniformes, en todo punto del reactor, con un control apropiado.”.
Reactor por Lotes 
La forma más general de las ecuaciones de balance de materiales y de energía para las especies de interés, es:

 |
1. |
Donde: V es el volumen del reactor; ci es la concentración del componente i; cj representa la concentración de otras especies que pueden influir las velocidades de formación o consumo de i en la reacción y r(ci, cj) es la velocidad volumétrica de formación de ci por la reacción.
También se puede escribir un balance de masa global para el sistema:
 |
2. |
Suponiendo que la densidad total de la fase líquida (ρ) es constante, el volumen de líquido permanece constante, y se puede sacar V del diferencial de la ecuación anterior, para obtener:
 |
3. |
Con la densidad (ρ), y las capacidades caloríficas constantes, la ecuación de conservación de la energía se puede escribir como:
 |
4. |
Donde: cp es la capacidad calorífica; ΔHR es el calor de reacción y rX es la velocidad volumétrica del incremento en la masa de células secas.
Aunque el biorreactor se opera por lotes, la ecuación de balance de energía contiene los términos para el flujo de calor del reactor asociado con el control de la temperatura (Q) y para la generación de calor por agitación (-W, trabajo de eje).
Como ejemplo, el crecimiento microbiano puede representarse por dos ecuaciones para la masa de células y el sustrato, utilizando el modelo de Monod:
 |
5. |
 |
6. |
Con condiciones iniciales X(0) = X0 ; cS(0) = cS0
Estas ecuaciones pueden sumarse después de multiplicar la ecuación 6 por YX/S para obtener:
Y de esta forma:
 |
7. |
Expresando X en función de cS, a partir de la ecuación anterior y reemplazando el resultado en la ecuación 6, se tiene:
 |
8. |
Ecuación que puede integrarse analíticamente para obtener:
 |
9. |
En esta ecuación, cS está implícita y el tiempo en el cual se consume el sustrato, puede encontrarse calculando valores de t correspondientes a valores específicos de la concentración de sustrato.
Si en el cultivo se forma un producto que puede estar parcialmente asociado o no asociado al crecimiento microbiano, de la forma:
 |
10. |
El balance de materiales para el sustrato debe reescribirse para contabilizar la conversión de sustrato en producto, (ecuación 11), y las tres ecuaciones de balance de material que resultan: ecuaciones 5, 10 y 11, pueden resolverse numéricamente para obtener los perfiles de concentración típicos.
 |
11. |
Muerte de células en un cultivo por lotes
En un cultivo en crecimiento, algunas células pueden volverse inactivas o morir, como resultado de errores en la auto síntesis (mala interpretación del ADN, por ejemplo). No obstante, la fracción de células viables en los cultivos bacteriales puede ser bastante alta en el crecimiento por lotes, las células eucariotas pueden morir a velocidades apreciables, y así, la viabilidad de ese cultivo será menor del 100%. Si se considera que únicamente las células viables (Xv) generan células no viables (Xnv) con una cinética de primer orden, en función de la concentración de células viables con una constante de velocidad de reacción k, se tiene, para el crecimiento microbiano:
 |
12. |
 |
13. |
El crecimiento de la población total de células está dado por:
 |
14. |
Si se considera que m es aproximadamente constante para la mayor parte de la fase exponencial del crecimiento por lotes, la ecuación 12 puede integrarse para Xv(t) y el resultado se sustituye en la ecuación 14 para XT. La integración de la ecuación que resulta, proporciona la concentración de células viables y la relación de viabilidad (Xv /XT):
 |
15. |
 |
16. |
Si el inóculo se compone principalmente de células viables, Xv(0)/XT(0) es aproximadamente igual a 1, y la expresión para la viabilidad, se reduce para tiempos lo suficientemente grandes (exp(µ – k)t >1) a:
 |
17. |
Esto es, la viabilidad fraccional permanece constante para la mayor parte del período exponencial de crecimiento. Si la velocidad de muerte k es igual a la velocidad de crecimiento, µ, se tiene entonces un crecimiento lineal de la biomasa total:
 |
18. |
Fuente: “Reactor por lotes”.
OPERACIÓN EN MODO DE CULTIVO SEMICONTINUO (FEED BATCH)
“Este tipo de operación es una forma intermedia entre la operación por lotes y la continua, incrementando la duración de la fermentación por lotes y de la productividad global del reactor.”.
Reactor por lotes alimentado (Fed-batch)
“En la tecnología de operación por lotes con alimentación repetida, el fermentador no se descarga completamente después de la reacción; el residuo se usa como inóculo para la siguiente corrida.”.

| Figura 6. Representación esquemática de un reactor por lotes alimentado. F es la corriente de entrada, cSA la concentración de sustrato en la alimentación, V es el volumen de la mezcla de fermentación y X la concentración de biomasa en la mezcla de fermentación. Fuente: “Reactor por lotes alimentado (Fed-batch)”. |
A continuación, se analiza la operación por lotes con alimentación, con velocidades de alimentación constantes y la operación por lotes con alimentación repetida. El punto de partida es la formulación de los balances de materiales para la biomasa, el sustrato y el producto junto con un balance total de materiales que es necesario puesto que el volumen del reactor cambia con el tiempo. Con la suposición que la densidad del líquido es constante, estas ecuaciones son:
 |
1A. |
 |
1B. |
 |
1C. |
 |
1D. |
Donde: cSA es la concentración de sustrato en el afluente y π es la velocidad específica de formación de producto. Si por el momento se omite la formación de producto, las ecuaciones de balance de materiales son:
 |
2A. |
 |
2B. |
 |
2C. |
Estas ecuaciones son similares a las de un quimiostato, con una importante diferencia; el término F/V, análogo a la velocidad de dilución D, cambia con el tiempo, puesto que V aumenta, mientras que D es constante para la operación quimiostática en estado estacionario.
Los balances de células y sustrato se pueden combinar e integrar para obtener:
 |
3. |
Si la concentración de sustrato en el afluente cSA, satisface la ecuación:
 |
4. |
Se tiene:
 |
5. |
Lo cual también es cierto para tiempos muy largos (es decir, para t >> V/F), en los cuales el término exponencial es pequeño.
A continuación, se analiza un caso especial. Si la velocidad de alimentación F es constante, se puede esperar, por comparación con el comportamiento del quimiostato, un estado cuasi estacionario en el período en donde la concentración celular es constante con respecto al tiempo, es decir, dX/dt ~ 0. Lo anterior requiere que la velocidad específica de crecimiento m, a F/V, debe disminuir como V se incrementa en el tiempo. Si m decrece continuamente, la concentración de sustrato debe disminuir con el tiempo (por esto dcS/dt no puede ser cero). Reemplazando la relación de Monod para m, se obtiene
 |
6. |
La masa total de células (XV) con estas condiciones está dada por
 Constante Constante |
7. |
Por esta razón, la masa total de células crece linealmente con el tiempo.
Ahora, se contempla como la velocidad específica de crecimiento debe variar bajo condiciones de estado cuasi estacionarias. Como F es constante, V crece linealmente con el tiempo (V = V0 + Ft) y
 |
8. |
Inicialmente, cuando V ~ V0
 ~ ~  |
9. |
Cuando el tiempo se hace mayor el volumen crece y V >> V0, por ello:
 ~ ~  |
10. |
La velocidad específica de crecimiento decrecerá rápidamente al comienzo y luego a una velocidad mucho más lenta a medida que transcurra el tiempo. Esto puede observarse numéricamente al solucionar las ecuaciones de balance de biomasa y sustrato. Para simplificarlas, se introducen las siguientes variables adimensionales:
Los balances de materiales se convierten en:
Si se considera el caso en el cual F no es constante y varía con el tiempo, se puede seleccionar F de tal forma que F/V sea constante, indicado por l.
Esto implica  Por lo tanto
Por lo tanto
 ; ;  |
12. |
Por lo anterior, el sistema con alimentación exponencial alcanzará las concentraciones de estado estacionario correspondientes a las del quimiostato. Tanto X como cS se pueden mantener en valores constantes.
Fuente: “Reactor por lotes alimentado (Fed-batch)”.
OPERACIÓN EN MODO DE CULTIVO CONTINUO (QUIMIOSTATO)
“El uso de reactores continuos de tanque agitado, con el fin de extender la duración de un cultivo microbial, se implementó en la década de 1950 por Novick y Szilard (1950) y Monod (1950). El hecho que un reactor continuo de tanque agitado se podía utilizar para mantener el crecimiento microbial en su valor de estado estacionario, el cual puede variarse desde cualquier velocidad de crecimiento hasta la máxima m max , fue un avance muy importante, ya que acabó con la tradicional manera de pensar en el sentido que el tiempo para el crecimiento estacionario de los microorganismos era únicamente posible a la máxima velocidad, correspondiente al tiempo mínimo de replicación que aparece en los cultivos por lotes. Por consiguiente, el empleo de biorreactores continuos de mezcla completa para el estudio de la fisiología microbiano, condujo a importantes avances en la comprensión del ciclo celular, la regulación metabólica y la formación de productos.”.
El Quimiostato: el reactor continuo ideal de tanque agitado

| Figura 7. Esquema de un biorreactor continuo de tanque agitado. Por lo general, se controlan las velocidades de flujo de nutrimentos al reactor, el pH y la temperatura. X indica el peso de células secas, cS es la concentración de sustrato y F es el flujo de nutrimentos al reactor. Fuente: “El Quimiostato: el reactor continuo ideal de tanque agitado”. |
Las ecuaciones de balance de materiales se pueden formular para cada una de las variables de importancia del reactor. Si se supone el caso en el cual únicamente un sustrato (S) limita la velocidad de crecimiento de los organismos y que la velocidad volumétrica de crecimiento está dada por m X, se tienen las siguientes ecuaciones:
 |
1A. |
 |
1B. |
 |
1C. |
Cuando los flujos volumétricos de entrada y de salida, Fe, Fsal, se mantienen constantes e iguales a F, las ecuaciones se simplifican a: (nótese que dX/dt ya no es igual a mX, como si sucede durante el crecimiento por lotes)
 |
2A. |
 |
2B. |
La relación, F/V se denomina generalmente como velocidad de dilución (D), con unidades recíprocas de tiempo. Esta velocidad de dilución es el inverso del tiempo promedio de residencia, t, y es igual al número de veces que una cantidad de mezcla de reacción equivalente al volumen del reactor pasa a través del recipiente de reacción, por unidad de tiempo. En estado estacionario (EE), las derivadas con respecto al tiempo se hacen iguales a cero, y la ecuación para la concentración celular tiene la solución:
 |
3. |
Cuando la corriente de alimentación es estéril (lo cual casi siempre ocurre), X0 es igual a cero, y las dos soluciones posibles para la ecuación anterior, son:
 ó ó |
 |
4. |
En el caso inusual en el cual la velocidad específica de crecimiento del cultivo [µ(cS)] es independiente de la concentración de sustrato y, además, es constante, la concentración de células en estado estacionario (XEE) cuando la velocidad de dilución es igual a µ, es indeterminada. La solución de la segunda ecuación de balance de materiales muestra que la concentración de sustrato en estado estacionario también es indeterminada, no obstante que tanto XEE como cSEE deben satisfacer:
 |
5. |
Y así, es posible obtener un intervalo de valores para las concentraciones de células y de sustrato.
Esto puede ser visto experimentalmente, cuando las concentraciones de entrada de sustrato son muy bajas; también se observa que las concentraciones de células y de sustrato varían con el tiempo.
Generalmente, sin embargo, la velocidad específica de crecimiento es función de la concentración de sustrato. Cuando se utiliza la relación de Monod entre µ y cS , las ecuaciones de balance de materiales ya no se indeterminan y se obtiene:
 |
6. |
Ecuación que puede resolverse para cS :
 Siempre que Siempre que  |
7. |
Y de la ecuación de balance para el sustrato se tiene:
 |
8. |
Y al reemplazar D = m en la ecuación anterior:
 |
9. |
La segunda solución de estado estacionario se obtiene cuando XEE = 0. El valor correspondiente a la concentración de sustrato es cSEE = cS0. Este estado estacionario se denomina como «lavado», puesto que las células ya no están presentes en el reactor. La velocidad de dilución a la cual ocurre el lavado, puede hallarse examinando la ecuación 6. Cuando cSEE es igual a la concentración de sustrato en la corriente de alimentación, se encuentra que la velocidad de dilución es:
 |
10. |
La máxima velocidad de dilución es ligeramente menor que la máxima velocidad específica de crecimiento. Si la velocidad de dilución es mayor que este valor, el sistema tiende a la segunda solución de estado estacionario XEE = 0. Esto puede observarse a partir del comportamiento de cEE . Como D → µmax , cEE se vuelve indeterminada.
Tabla 1. Resumen de las soluciones de estado estacionario.
 es indeterminada si
es indeterminada si 

 siempre que
siempre que 




Los valores de KS son pequeños, particularmente cuando se comparan con los de la concentración de sustrato en la corriente de entrada, cS0. Por ello, la concentración de sustrato en el estado estacionario es muy pequeña e independiente de la concentración de sustrato en la corriente de entrada. Las soluciones no-triviales pueden aplicarse únicamente en el caso en donde la concentración es mucho mayor que cSEE . Si cS0 < cSEE, la velocidad específica de crecimiento m es constante, las ecuaciones se indeterminan y pueden observarse una gran variedad de estados estacionarios.
La operación de un reactor continuo de tanque agitado bajo condiciones en las cuales sólo un sustrato limita el crecimiento, da como resultado un valor casi constante de la concentración de sustrato sobre un amplio intervalo de velocidades de dilución. Otros sustratos, los cuales se consumen a velocidades proporcionales a la velocidad específica de crecimiento de biomasa, también tendrán concentraciones de estado estacionario que son independientes de D y, además, son constantes. Por esta razón, este tipo de operación de biorreactores se denomina comúnmente como operación quimiostática (es decir, el ambiente químico permanece estático).
Cuando la velocidad de dilución se aproxima a µmax, la concentración de células desciende rápidamente. La operación del quimiostato a velocidades de dilución cercanas a µmax es experimentalmente complicada debido a la sensibilidad del sistema. Pequeñas variaciones de la concentración de sustrato en la corriente de entrada, la velocidad del flujo de alimentación o en la velocidad de crecimiento de los microorganismos, pueden ocasionar el lavado de las células.
La productividad volumétrica de células en un quimiostato está dada por DXEE (expresada por lo general, en unidades de gramos de células por litro de reactor por hora). La velocidad de dilución a la cual la productividad es máxima se encuentra a partir de:
 de esta forma de esta forma  |
11. |
La concentración de biomasa correspondiente es:
 |
12. |
Si KS << cS0 la productividad volumétrica se reduce a YX/SµmaxcS0.
Comparación entre la productividad de un cultivo por lotes y la de un cultivo continuo
La productividad de biomasa de cultivos por lotes y continuos puede compararse bajo las mismas condiciones siempre que cS0 >> KS. La solución de la ecuación de balance de biomasa para el cultivo por lotes puede simplificarse si se supone que µ ~ µmax durante la fase exponencial del crecimiento. De esta forma, se obtiene el tiempo de duración de la fase exponencial texp:
 |
13. |
Ecuación que se puede organizar en la forma:
 |
14. |
El tiempo total necesario para la fermentación por lotes, es la suma de los tiempos de las fases de adaptación y exponencial y de los tiempos empleados en vaciar, esterilizar e inocular de nuevo el reactor. Éstos últimos reúnen en una sola constante denominada tiempo muerto tm . Con base en lo anterior, el tiempo total de la operación por lotes será la suma del tiempo de la fase exponencial de crecimiento y el tiempo muerto:
 |
15. |
Si la concentración inicial de sustrato (cS0) es igual a la de la alimentación al quimiostato, la biomasa producida en este tipo será aproximadamente YX/ScS0. La productividad volumétrica del reactor por lotes es por lo tanto YX/ScS0 /tlotes. La comparación de ésta con la máxima productividad de un quimiostato (ecuación 11), permite obtener:
 |
16. |
Típicamente, la relación de la concentración final de células a la concentración de células en el inóculo (X/X0) es aproximadamente igual a 10. Por esta razón, el cultivo continuo ofrece un mínimo de 2,3 veces la productividad de una fermentación por lotes.
Fuente: “El Quimiostato: el reactor continuo ideal de tanque agitado”.
Reactores de flujo en pistón y de lecho empacado
El extremo opuesto al reactor de mezcla completa es el reactor de flujo en pistón, en el cual, el fluido se desplaza a lo largo de un tubo o canal de forma que se presenta un mezclado imperceptible en la dirección del flujo (la dirección axial), pero hay una mezcla bastante buena en la dirección radial. Tales reactores son comunes en la industria química, pero por razones que se considerarán más adelante, son poco utilizados para el crecimiento de células. Sin embargo, estos reactores se utilizan frecuentemente para células inmovilizadas y reacciones con enzimas. La isomerización de glucosa a fructosa, que es un paso clave en la producción de jarabe de maíz con un elevado contenido de fructosa, es un ejemplo importante de un proceso comercial que se lleva a cabo en un reactor de lecho de enzimas inmovilizadas. Los diagramas esquemáticos de un reactor de flujo en pistón y de uno de lecho empacado, se presentan a continuación:

Considérese primero un reactor de flujo en pistón sin catalizador y que contiene células o una enzima. Si la velocidad superficial en la dirección axial (dirección z) es us (la velocidad superficial es la velocidad lineal promedio que el fluido debería tener si no hubiera empaque en el reactor y es igual a F/A, donde A es el área transversal del reactor y F es el flujo volumétrico dentro del mismo), se pueden escribir las siguientes ecuaciones de estado estacionario para el balance de células y de sustrato:

1.
Donde rX y rS son las velocidades de reacción basadas en los volúmenes de líquido.
Si la velocidad axial es constante, como debería ser el caso si la densidad del fluido permanece constante, estas ecuaciones se convierten en:

2.
Las cuales pueden reescribirse en función de un tiempo constante característico q (= z / us )

3.
Por consiguiente, las ecuaciones se reducen a las de un reactor por lotes, excepto que q reemplaza al tiempo t . Las condiciones iniciales y finales sobre las cuales estas ecuaciones se integran, son las siguientes:
q = 0
X = X0
cS = cS0
z = L
q = L/us
X = Xfinal
cS = cSfinal
Así, las soluciones para las ecuaciones anteriores para varias expresiones de velocidad (por ejemplo, la ecuación de Monod) pueden tomarse directamente de los resultados para un reactor por lotes.
El reactor de flujo en pistón ofrece un grado de conversión de sustrato mayor que el de un reactor de tanque agitado de igual volumen (y, por lo tanto, igual tiempo de residencia), porque la velocidad de reacción en un reactor de tanque agitado será menor que en un reactor de flujo en pistón. En un reactor de tanque agitado, la concentración de sustrato cae inmediatamente al valor de salida y la velocidad de reacción se determina por este valor. Con una cinética del tipo Monod, la velocidad decrece al disminuir la concentración de sustrato; por ello, el reactor de flujo en pistón ofrece la ventaja de mayores velocidades de reacción que en un reactor de tanque agitado, debido a que la concentración de sustrato desciende desde su valor inicial a lo largo de la dirección axial.
Las principales dificultades en la operación de un reactor de flujo en pistón con células suspendidas radican en la necesidad de proveer un inóculo continuo de células (X0 debe suministrarse a la entrada del reactor), y en el mantenimiento de un pH constante, así como en el suministro de oxígeno a lo largo de la longitud del reactor. Estos problemas generalmente son tan extremos que existen pocos ejemplos de reactores biológicos perfectos de flujo en pistón. Algunos tipos de reactor pueden aproximarse como límite, al comportamiento de flujo en pistón; por ejemplo, un reactor con circulación pneumática de líquido con una fuerte circulación hacia arriba de líquido, o un gran tanque de tratamiento de aguas de desecho.
En contraste con el crecimiento microbial, los reactores de flujo en pistón y de lecho empacado se emplean comúnmente con enzimas libres e inmovilizadas. Aquí las necesidades de suministro de oxígeno y control de pH no se aplican usualmente, ya que muchas reacciones enzimáticas no requieren oxígeno y no generan ácidos o bases. Como se mencionó, una de las mayores aplicaciones industriales de este tipo es la isomerización de glucosa a fructosa para la producción de jarabe de maíz con alto contenido de fructosa. Esta reacción está catalizada por glucosa isomerasa inmovilizada sobre un soporte, tal como alúmina, en reactores de lecho empacado.
En un reactor de lecho empacado, la velocidad axial del fluido será mayor que en un reactor abierto de flujo en pistón y depende de la fracción de espacio vacío e, definida como:
| ε = Volumen libre del reactor/Volumen total del reactor = 1 – (Volumen total de partículas/Volumen total del reactor) |
4.
Y la velocidad de fluido intersticial, vi, es:
| vi = F/(área de la sección transversal) = F/(V/L) |
5.
La velocidad intersticial se emplea luego para calcular el tiempo de residencia del líquido τ. Éste tiene el valor τ = ε (V/F). En el caso de enzimas en solución, la fracción de espacio vacío ε será igual a la unidad. Un valor típico de e para enzimas inmovilizadas sobre soportes esféricos es aproximadamente igual a 0,4. En el caso de enzimas libres o inmovilizadas, el balance de materia para el sustrato tiene la forma:
6.
Y es posible la integración analítica de esta ecuación para algunas cinéticas comunes. La tabla 1 muestra ejemplos de la expresión del tiempo de residencia en función de los parámetros de la expresión de velocidad. Nótese que V’M es el producto de VM (máxima velocidad de reacción por unidad de volumen de catalizador -líquido más sólido-) y el volumen de catalizador por unidad de volumen de líquido (1-ε)/ε. De esta manera, V’M = VM(1-ε)/ε.
Tabla 1. Tiempo de residencia t en función de la conversión de sustrato [d = (cS0 –cS)/cS0] para reacciones enzimáticas en reactores de flujo en pistón y de lecho empacado.
Tiempo de residencia (τ = εL/us )
Michaelis – Menten 

Inhibición por sustrato 

Fuente: “Reactores de flujo en pistón y de lecho empacado”.
RESUMEN DE MODOS DE OPERACIÓN
El biorreactor puede operarse en una de las siguientes formas:
Operación discontinua o por lotes (batch),
Operación continua, o
Varios tipos de operaciones semicontinuas.
En la siguiente tabla, se resumen los algunas de las distintas formas de operación de un reactor biológico.
Comentarios
Curva: concentración-tiempo
Balance de masa en un reactor ideal
Por lotes

Inoculación y carga de todos los nutrimentos y sustratos al mismo tiempo y hasta consumo total


Por lotes con alimentación intermitente

Varios esquemas volumen – tiempo y velocidades de alimentación


Por lotes extendida

La concentración del sustrato (cS), permanece constante


Por lotes repetida

Después que ha ocurrido la reacción en un lote, una pequeña cantidad del fermento se saca del reactor para que sirva como inóculo para el siguiente lote del proceso
 Cultivo continuo (quimiostato)
Cultivo continuo (quimiostato)

Con flujos de entrada y de salida del medio de reacción. El reactor se denomina quimiostato, en aquellos casos en los cuales la densidad celular y la concentración permanecen constantes
Antes de estado estacionario: 
En estado estacionario: 
Antes de estado estacionario: 
En estado estacionario: 
Cascada de reactores continuos de tanque agitado
Con o sin alimentaciones intermedias y recirculación del medio de cultivo o del biocatalizador


 Reactor continuo de tanque agitado con recirculación de biocatalizador
Reactor continuo de tanque agitado con recirculación de biocatalizador


 Combinación de reactores (Reactor continuo de tanque agitado y reactor de flujo en pistón)
Combinación de reactores (Reactor continuo de tanque agitado y reactor de flujo en pistón)

El reactor continuo de tanque agitado sirve como un reactor de inoculación, ya que la operación en estado estacionario de un reactor de flujo en pistón no es posible debido al desplazamiento del biocatalizador
 1)
1) 
2) 
Fuente: “Modos de operación”.


































































































































































































































































![clip_image002[4] clip_image002[4]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0024_thumb.jpg)
![clip_image003[4] clip_image003[4]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0034_thumb.png)




![clip_image008[4] clip_image008[4]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0084_thumb.png)
![clip_image011[4] clip_image011[4]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0114_thumb.png)











![clip_image003[1] clip_image003[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0031_thumb.jpg)
![clip_image005[1] clip_image005[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0051_thumb.jpg)



![clip_image015[2] clip_image015[2]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0152_thumb.png)
![clip_image017[1] clip_image017[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0171_thumb.jpg)
![clip_image018[3] clip_image018[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0183_thumb.png)
![clip_image020[1] clip_image020[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0201_thumb.jpg)
![clip_image001[6] clip_image001[6]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0016_thumb.png)
![clip_image003[3] clip_image003[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0033_thumb.jpg)
![clip_image002[1] clip_image002[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0021_thumb.jpg)
![clip_image003[3] clip_image003[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0033_thumb.png)
![clip_image002[1] clip_image002[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0021_thumb.png)
![clip_image005[1] clip_image005[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0051_thumb-1.jpg)
![clip_image008[1] clip_image008[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0081_thumb.png)
![clip_image009[1] clip_image009[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0091_thumb.png)
![clip_image011[1] clip_image011[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0111_thumb-1.png)
![clip_image012[1] clip_image012[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0121_thumb.png)


![clip_image017[1] clip_image017[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0171_thumb-1.jpg)
![clip_image003[3] clip_image003[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0033_thumb-1.png)
![clip_image004[1] clip_image004[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0041_thumb.png)
![clip_image006[3] clip_image006[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0063_thumb-1.png)

![clip_image002[1] clip_image002[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0021_thumb-1.jpg)
![clip_image003[5] clip_image003[5]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0035_thumb.png)
![clip_image005[3] clip_image005[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0053_thumb.jpg)
![clip_image006[5] clip_image006[5]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0065_thumb.png)
![clip_image008[1] clip_image008[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0081_thumb.jpg)
![clip_image009[3] clip_image009[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0093_thumb.png)
![clip_image013[1] clip_image013[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0131_thumb.jpg)
![clip_image015[1] clip_image015[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0151_thumb.png)
![clip_image017[3] clip_image017[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0173_thumb.jpg)
![clip_image002[3] clip_image002[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0023_thumb.png)

![clip_image006[1] clip_image006[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0061_thumb.jpg)
![clip_image008[3] clip_image008[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0083_thumb.png)
![clip_image003[1] clip_image003[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0031_thumb-1.jpg)
![clip_image004[3] clip_image004[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0043_thumb.png)
![clip_image006[7] clip_image006[7]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0067.png)
![clip_image008[3] clip_image008[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0083_thumb.jpg)

![clip_image014[1] clip_image014[1]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0141_thumb.jpg)
![clip_image015[3] clip_image015[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0153_thumb.png)
![clip_image001[7] clip_image001[7]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0017_thumb.png)
![clip_image003[7] clip_image003[7]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0037_thumb.png)
![clip_image005[5] clip_image005[5]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0055_thumb.jpg)
![clip_image007[7] clip_image007[7]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0077_thumb.png)
![clip_image009[6] clip_image009[6]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0096_thumb.jpg)

![clip_image010[3] clip_image010[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0103_thumb.png)
![clip_image003[3] clip_image003[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0033_thumb-1.jpg)
![clip_image002[3] clip_image002[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0023_thumb.jpg)
![clip_image004[5] clip_image004[5]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0045_thumb.png)
![clip_image006[3] clip_image006[3]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0063_thumb.jpg)
![clip_image009[8] clip_image009[8]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0098_thumb.jpg)
![clip_image011[5] clip_image011[5]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0115_thumb.png)
![clip_image003[5] clip_image003[5]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0035_thumb.jpg)
![clip_image001[11] clip_image001[11]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image00111_thumb.png)
![clip_image005[7] clip_image005[7]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0057_thumb.jpg)
![clip_image006[11] clip_image006[11]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image00611_thumb.png)
![clip_image009[7] clip_image009[7]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0097_thumb.png)
![clip_image007[11] clip_image007[11]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image00711_thumb.png)
![clip_image003[7] clip_image003[7]](https://bioreactorcrc.files.wordpress.com/2021/03/clip_image0037_thumb.jpg)


![clip_image002[1] clip_image002[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0021_thumb.jpg)




![clip_image001[10] clip_image001[10]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image00110_thumb.png)
![clip_image002[1] clip_image002[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0021-1.jpg)
![clip_image003[1] clip_image003[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0031_thumb.png)
![clip_image001[1] clip_image001[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0011_thumb.png)
![clip_image003[1] clip_image003[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0031-1.png)
![clip_image005[1] clip_image005[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0051.png)
![clip_image006[1] clip_image006[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0061_thumb.png) Cuando una
Cuando una 
![clip_image003[1] clip_image003[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0031_thumb.jpg)
![clip_image006[3] clip_image006[3]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0063.png)
![clip_image002[1] clip_image002[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0021-2.jpg)



![clip_image005[3] clip_image005[3]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0053.png)
 Figure 16. Chemical structure of 8-oxo-7, 8-dihydro-2′-deoxyguanosine (8-oxodG; 8-OHdG), guanine and 8-oxo-7, 8-dihydroguanine (8-oxoGua).
Figure 16. Chemical structure of 8-oxo-7, 8-dihydro-2′-deoxyguanosine (8-oxodG; 8-OHdG), guanine and 8-oxo-7, 8-dihydroguanine (8-oxoGua).![clip_image002[7] clip_image002[7]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0027.jpg)
![clip_image002[4] clip_image002[4]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0024.png)
![clip_image003[13] clip_image003[13]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image00313_thumb.png)
![clip_image003[15] clip_image003[15]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image00315.png)
![clip_image005[5] clip_image005[5]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0055.jpg)
![clip_image006[13] clip_image006[13]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image00613_thumb.png)
![clip_image002[1] clip_image002[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0021.png)
![clip_image005[1] clip_image005[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0051-1.png)
![clip_image006[1] clip_image006[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0061_thumb-1.png)
![clip_image009[1] clip_image009[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0091_thumb.jpg)


![clip_image002[1] clip_image002[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0021_thumb-1.jpg)
![clip_image003[1] clip_image003[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0031_thumb-2.png)
![clip_image005[1] clip_image005[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0051_thumb.png)
![clip_image006[1] clip_image006[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0061_thumb-2.png)
![clip_image008[1] clip_image008[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0081_thumb.jpg)
![clip_image009[1] clip_image009[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0091_thumb.png)
![clip_image011[2] clip_image011[2]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0112_thumb.png)

![clip_image014[1] clip_image014[1]](https://bioreactorcrc.files.wordpress.com/2021/02/clip_image0141_thumb.png)
